แบบจำลองอะตอม
แนวคิดในการพัฒนาแบบจำลองอะตอม
ในสมัยโบราณมีนักปราชญ์ชาวกรีกชื่อ ดิโคริตุส (Democritus) เชื่อว่าเมื่อย่อยสารลงเรื่อย ๆ จะได้ส่วนที่เล็กที่สุดซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคขนาดเล็กที่สุดว่า อะตอม ซึ่งคำว่า "อะตอม"(atom) เป็นคำซึ่งมาจากภาษากรีกว่า (atomas) แปลว่า แบ่งแยกอีกไม่ได้
สสารทั้งหลายประกอบด้วยอนุภาคที่เล็กที่สุด จะไม่สามารถมองเห็นได้และจะไม่สามารถแบ่งแยกให้เล็กลงกว่านั้นได้อีก แต่ในสมัยนั้นก็ยังไม่มีการทดลอง เพื่อพิสูจน์และสนับสนุนแนวความคิดดังกล่าว
แบบจำลองอะตอม (Atomic model) เป็นภาพทางความคิดที่แสดงให้เห็น รายละเอียดของโครงสร้างอะตอมที่สอดคล้อง กับผลการทดลองและใช้อธิบายปรากฏการณ์ ของอะตอมได ้
แบบจำลองอะตอมของดอลตัน
อะตอมมีลักษณะทรงกลม และเป็นอนุภาคที่มีขนาดเล็กที่สุด ซึ่งแบ่งแยกไม่ได้ และไม่สามารถสร้างขึ้นใหม่หรือทำให้สูญหายได้
จอห์น ดอลตัน นักวิทยาศาสตร์ชาวอังกฤษ เป็นนักเคมีคนแรกที่เสนอแนวคิดเกี่ยวกับอะตอม ซึ่งมีสาระสำคัญดังนี้
ธาตุประกอบด้วยอนุภาคเล็ก ๆ หลายอนุภาค อนุภาคเหล่านี้เรียกว่า อะตอม ซึ่งแบ่งแยกและทำให้สูญหายหรือสร้างขึ้นใหม่ไม่ได้
อะตอมของธาตุชนิดเดียวกันย่อมมีสมบัติเหมือนกัน มีมวลเท่าๆ กัน แต่มีสมบัติแตกต่างจากอะตอมของธาตุอื่น ๆ
สารประกอบเกิดจากอะตอมของธาตุมากกว่า 1 ชนิด ทำปฏิกิริยากันในอัตราส่วนที่เป็นเลขลงตัวอย่างง่าย
แบบจำลองอะตอมของทอมสัน
อะตอม ประกอบด้วย อนุภาคโปรตอนและอิเล็กตรอนกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาพที่เป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับประจุลบ
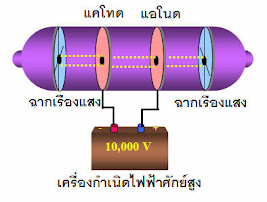
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด ได้ผลสรุปด้งนี้
ค่าอัตราส่วนประจุต่อมวลของอนุภาคลบหรืออิเล็กตรอน (e ) มีค่าเท่ากับ คูลอมบ์ต่อกรัม ซึ่งมีค่าคงที่เสมอไม่ขึ้นอยู่กับชนิดของก๊าซและโลหะที่ใช้ทำแคโทด
สรุปแบบจำลองอะตอมของทอมสัน
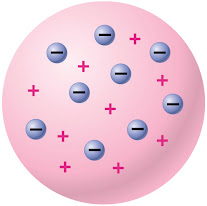
อะตอมมีลักษณะเป็นทรงกลุม มีอนุภาคที่มีประจุบวก เรียกว่า โปรตอน อนุภาคที่มีประจุลบ เรียกว่า อิเล็กตรอน และจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนกระจายอยู่ทั่วไปในทรงกลม
การทดลองที่สนับสนุนแบบจำลองอะตอมของทอมสัน
➤สโตนีย์ ได้ศึกษาผลงานของฟาราเดย์ และเป็นผู้สรุปว่า ไฟฟ้าประกอบด้วยอนุภาคทางไฟฟ้าและตั้งชื่ออนุภาคนี้ว่า อิเล็กตรอน ซึ่งเป็นอนุภาคขนาดเล็กในอะตอมของธาตุ
➤ฟาราเดย์ ได้ศึกษาเกี่ยวกับการแยกสารละลายด้วยกระแสไฟฟ้าและได้ตั้งกฏการแยกสารด้วยไฟฟ้า
➤รอเบิร์ต แอนดูรส์ มิลลิแกน ได้ทำการทดลองต่อจากทอมสัน เพื่อหาประจุที่มีอยู่ในอิเล็กตรอนแต่ละตัว เรียกการทดลองนั้นว่า
แต่ละตัว มีประจุเท่ากับ คูลอมบ์
แต่ละตัว มีมวลเท่ากับ คูลอมบ์
ออยแกน โกลด์สไตน์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองโดยใช้หลอดรังสีแคโทด พบว่า อนุภาคบวก มีค่าอัตราส่วนประจุต่อมวลไม่คงที่ ขึ้นอยู่กับชนิดของก๊าซ และอนุภาคบวกที่เกิดจากไฮโดรเจน เรียกว่า โปรตอน
💚💚💚💚💚💚💚💚💚💚💚💚💚💚💚💚
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
อะตอม ประกอบด้วย นิวเคลียสที่มีโปรตอนรวมอยู่ตรงกลาง มีขนาดเล็ก และมีมวลมาก และมีอิเล็กตรอนซึ่งมีมวลน้อยวิ่งอยู่รอบ ๆ นิวเคลียส
ลอร์อเออร์เนสต์ รัทเทอร์ฟอร์ด นักวิทยาศาสตร์ชาวอังกฤษ และฮันส์ ไกเกอร์ นักวิทยาศาสตร์ชาวเยอรมัน ได้ทำการทดลองยิงอนุภาคแอลฟาไปยังแผ่นทองคำบาง ๆ เรียกการทดลองนี้ว่าการทดลองการกระเจิงรังสีอัลฟาของรัทเทอร์ฟอร์ด
จากการทดอลองพบว่า
◆ อนุภาคแอลฟาส่วนใหญ่วิ่งเป็นแนวเส้นตรงทะลุแผ่นทองคำบาง ๆ
◆ อนุภาคแอลฟาบางส่วนวิ่งเบี่ยงเบนไปจากแนวเส้นตรง
◆ อนุภาคแอลฟาส่วนน้อยสะท้อนกลับ
ดังนั้นรัทเทอร์ฟอร์ด เชื่อว่า น่าจะมีอนุภาคอีกชนิดหนึ่งอยู่ภายในนิวเคลียส ซึ่งไม่มีประจุ แต่มีมวลใกล้เคียงกับโปรตอน
เซอร์เจมส์ แชดวิก นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการทดลองยิงอนุภาคแอลฟา ( )ไปยังอะตอมของธาตุต่าง ๆ และได้สรุปว่า ในนิวเคลียสของอะตอมมีอนุภาคที่เป็นกลางทางไฟฟ้า เรียกว่า นิวตรอน ดังนั้นแบบจำลองอะตอม จึงมีลักษณะดังรูป
แบบจำลองอะตอมของนีลส์ โบร์
นีลส์ โบร์ นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,... ตามลำดับ
แบบจำลองอะตอมของกลุ่มหมอก
อะตอมจะประกอบด้วย กลุ่มหมอกของอิเล็กตรอนรอบ ๆ นิวเคลียส โดยมีทิศทางไม่แน่นอน โอกาสที่จะพบอิเล็กตรอนบริเวณใกล้นิวเคลียสมีมากกว่าบริเวณที่อยู่ห่างจากนิวเคลียส
เนื่องจากแบบจำลองอะตอมของโบร์ใช้อธิบายได้ดีเฉพาะธาตุไฮโรเจนซึ่งมีอิเล็กตรอนเพียงตัวเดียว ดังนั้นถ้าธาตุมีหลายอิเล็กตรอน ทฤษฏีของโบร์ไม่สามารถอธิบายได้ นักวิทยาศาสตร์จึงค้นคว้า ทดลองจนเกิดเป็นแบบจำลองอะตอมแบบกลุ่มหมอก ซึ่งมีลักษณะดังนี้
อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยความเร็วสูง วงโคจรไม่จำเป็นต้องเป็นวงกลมเสมอ
ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้
บริเวณกลุ่มหมอกหนาทึบ แสดงว่ามีโอกาสพบอิเล็กตรอนบริเวณนั้นมาก และบริเวณที่กลุ่มหมอกจาง แสดงว่ามีโอกาสพบอิเล็กตรอนน้อย





ไม่มีความคิดเห็น:
แสดงความคิดเห็น